Pisa, 24 novembre 2020
“Ma com’è possibile che abbiano realizzato un vaccino in così poco tempo? Sarà sicuro?”
Questi i dubbi che hanno sollevato in molti di fronte alle recenti notizie dello sviluppo di vaccini contro il Coronavirus, a distanza di nemmeno un anno dall’inizio della pandemia.
Cerchiamo allora di far chiarezza sulle modalità che hanno permesso di raggiungere questo traguardo riportando il contenuto di un briefing tenuto l’11 novembre 2020 dai Capi del Dipartimento della Salute del Regno Unito.
Il Prof. Jonathan Van-Tam (Deputy Chief Medical Officer, Department of health and social care) mostra nella prima slide la timeline dello sviluppo e messa in commercio di un vaccino come avviene in “peace-time”, ovvero come avviene di norma in periodo di non-emergenza.

I riquadri rossi indicano le fasi preliminari, gli studi preclinici effettuati in laboratorio per valutare il funzionamento e la tossicità del composto.
Dopo l’autorizzazione, a seguito dei risultati preclinici, viene avviato il trial clinico svolto sull’uomo.
Questo trial è suddiviso in 3 fasi sequenziali: la fase 1 coinvolge un piccolo gruppo di volontari per valutare la sicurezza e il dosaggio del vaccino; la fase 2 viene svolta su un gruppo più ampio e consiste nel valutare se il vaccino può generare una risposta immunitaria, ovvero se porta allo sviluppo di anticorpi specifici nell’uomo; infine, la fase 3 coinvolge un gruppo molto più ampio di volontari (per il Coronavirus si parla di 30.000-50.000 individui) e serve per valutare se il vaccino, oltre a generare una risposta immunitaria con anticorpi, protegga anche dalla malattia verso cui è stato sviluppato.
La valutazione della sicurezza del vaccino si svolge per tutte e tre le fasi del trial clinico.
A seguito della fase 3, lo studio sul vaccino viene sottoposto ad analisi da parte delle Agenzie di revisione di ogni paese (nel caso dell’Italia è l’AIFA) e solo dopo aver avuto l’approvazione può essere avviata la produzione e distribuzione.
Nel caso del Coronavirus si è venuta a creare una situazione emergenziale che ha richiesto degli adattamenti nel processo di sviluppo del vaccino: come viene mostrato in slide e spiegato da Van-Tam, tutti gli stadi e i processi sono svolti esattamente con le stesse modalità e protocolli di norma impiegati, nessuna fase è stata ridotta solo perchè è una situazione di emergenza.
La differenza sostanziale è che si passa a una fase successiva del trial clinico mentre è ancora in corso la precedente, e i dati raccolti da ogni fase possono essere analizzati dalle Agenzie di revisione mentre si sta svolgendo il trial e non solo quando questo è arrivato a conclusione.
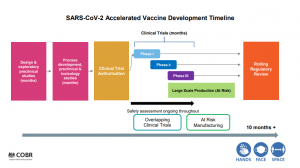
Le case farmaceutiche, inoltre, si sono prese il rischio di iniziare la produzione delle dosi di vaccino ancora prima di aver completato il trial e aver avuto l’approvazione dalle Agenzie di revisione, in modo da aver dosi già pronte per la messa in commercio: se il risultato del trial, però, fosse negativo e le Agenzie di revisione non approvassero il vaccino, le case farmaceutiche sarebbero costrette a distruggere le dosi prodotte perchè non potrebbero in alcun modo essere messe in commercio.
L’approvazione da parte delle Agenzie di revisione avviene tramite la valutazione dei dati ottenuti dalle fasi precliniche e dal trial, in modo da determinare l’adeguata sicurezza, efficacia e qualità del prodotto, seguendo rigidi standard, a prescindere che si tratti di una situazione emergenziale o meno. Il lavoro di monitoraggio, comunque, non si interrompe con la distribuzione del vaccino, ma continua anche successivamente per valutare i rischi e benefici durante l’uso clinico su larga scala.
E’ notizia di pochi giorni fa che sia Biotech/Pfizer che Moderna hanno concluso entrambe le fasi 3 degli studi clinici dei loro vaccini, riportando un’efficacia superiore al 90%; anche l’azienda farmaceutica AstraZeneca sta completando la fase 3 e i dati preliminari riportano un’efficacia del 90%: il prossimo step riguarda l’approvazione da parte delle Agenzie di revisione per poter mettere in commercio i farmaci.
Altra questione riguarda chi dovrà ricevere per primo il vaccino: a questo ha risposto il Professor Wei Shen Lim (Chair of the Joint Committee on Vaccination and Immunisation) riferendo che presumibilmente in una prima fase i vaccini dovranno essere garantiti ai soggetti più vulnerabili.
Il Professor Lim ha riportato le raccomandazioni ad interim, ovvero quelle che coi dati attuali portano a individuare le categorie più a rischio di complicanze da Covid-19, e a cui presumibilmente offrire i vaccini nella prima fase di distribuzione; in ordine:
1) ospiti delle case di riposo e gli operatori sanitari che vi lavorano;
2) persone con età avanzata (>65aa);
3) adulti con patologie pregresse;
4) adulti >50 anni.
Se verranno vaccinati tutti questi i soggetti della prima fase, si prevede sarà coperto il 99% dei soggetti a rischio di morire di Covid-19.
Questi sono i soggetti con priorità per ricevere il vaccino: altre categorie a cui indirizzare la vaccinazione dopo la prima fase dovranno essere individuate successivamente in base ai dati sull’andamento dell’epidemia.
I dati finora ottenuti sembrano incoraggianti, non resta che aspettare che i lavori di revisione da parte delle Agenzie diano esito positivo, e soprattutto che dopo la messa in commercio dei vaccini la platea a cui verranno offerti sia favorevole a ricevere la vaccinazione: come risaputo, infatti, una vaccinazione di massa è efficace se più del 90% dei soggetti a cui è rivolta si vaccina, altrimenti non viene interrotta la catena dei contagi.
In attesa dell’arrivo del vaccino, comunque, è bene non abbassare la guardia e continuare a combattere il virus con la prevenzione: indossare correttamente la mascherina, effettuare un lavaggio frequente delle mani e distanziamento sociale.
News-24.it è una testata giornalistica indipendente che non riceve alcun finanziamento pubblico. Se ti piace il nostro lavoro e vuoi aiutarci nella nostra missione puoi offrici un caffè facendo una donazione, te ne saremo estremamente grati.
































